Průkaz beta-laktamáz širokého spektra (ESBL) a typu AmpC u enterobakterií
18. červen 2008 | Jaroslav Hrabák, Václav Vaniš, Tamara Bergerová, Pavla Urbášková
A. Definice
- Širokospektré b-laktamázy - ESBL (extended-spectrum b-lactamases) jsou enzymy produkované některými mikroby, které hydrolyzují peniciliny, cefalosporiny všech generací a monobaktamy. Jsou inhibovány inhibitory b-laktamáz (např. klavulanovou kyselinou), nehydrolyzují karbapenemy a obvykle ani cefamyciny (např. cefoxitin).
- b-laktamázy typu AmpC jsou řadou mikrobů produkovány inherentně (např. druhy Enterobacter spp., Citrobacter freundii, Morganella morganii, Providencia spp., Serratia spp.). Hydrolyzují peniciliny, cefamyciny, většinu cefalosporinů a monobaktamy, nehydrolyzují karbapenemy a nejsou inhibovány inhibitory b-laktamáz (např. klavulanovou kyselinou).
B. Klinické a epidemiologické důsledky produkce b-laktamáz
- Efekt inokula buněk. Při vyšetření citlivosti producentů ESBL diluční metodou nebo diskovou difusní metodou v rutinním uspořádání (které vyžaduje koncentraci inokula buněk bakterií zhruba 105 buněk/ml), se mohou některé cefalosporiny in vitro falešně jevit jako citlivé. Při probíhající infekci je však přítomna vysoká koncentrace buněk původce (> 105 buněk/ml), která produkuje enzym v množství postačujícím k inaktivaci cefalosporinů a selhání léčby [1].
- Význam inducibilní produkce enzymu. Většina chromozomálních AmpC je inducibilních. Znamená to, že příslušný gen (např. blaDHA, blaCMY, blaMIR) není v běžných podmínkách exprimován, hodnoty minimální inhibiční koncentrace (MIC) nebo inhibiční zóny většiny b-laktamových antibiotik jsou v kategorii citlivosti, a také v klinické praxi je kmen k příslušným cefalosporinům citlivý. K indukci produkce AmpC dochází při kontaktu s některými antibiotiky (cefoxitin, imipenem) nebo inhibitory b-laktamáz (především klavulanovou kyselinou) [2, 3, 4]. Předpokládá se, že tato indukce je vyvolána specifickou interakcí induktoru s proteiny vážícími peniciliny (PBP), s následným spuštěním signální cesty, která vede k expresi daného genu. Expozice b-laktamovým antibiotikům, např. při jejich léčebné aplikaci, může způsobit selekci mutant, u nichž došlo k derepresi genu ampC těchto b-laktamáz [4]. Mutanty hyperprodukující b-laktamázu jsou obvykle rezistentní k většině penicilinů, cefalosporinů a aztreonamu. Citlivost zůstává zachována ke karbapenemům a in vitro obvykle také k cefalosporinům 4. generace (cefepim, cefpirom) [4], stejně jako u ESBL se však při léčebné aplikaci těchto antibiotik může uplatnit efekt inokula [1].
- Z epidemiologického hlediska představují oba typy rezistence vysoké riziko, neboť se mohou rychle šířit. Rychlejší horizontální šíření b-laktamáz zprostředkovávají transpozony nebo integrony, klony rezistentních kmenů se šíří vertikálně. Integrony v genových kazetách obvykle sdružují kromě genů b-laktamáz také geny determinující rezistenci k aminoglykosidům, chloramfenikolu, rifampicinu, sulfonamidům, případně i k dalším antibiotikům [4, 5]. Frekvence výskytu kmenů se získanou rezistencí k b-laktamovým antibiotikům v důsledku produkce inaktivujících enzymů ESBL nebo AmpC je rozdílná v závislosti na druhu enterobakterie, na typu nemocničního zařízení, významné rozdíly jsou mezi odděleními jedné nemocnice, mezi nemocnicemi, zeměmi a kontinenty. V České republice (ČR) se sleduje rezistence k cefalosporinům se širokým spektrem účinku u izolátů z krve pacientů s bakterémií způsobenou E. coli nebo Klebsiella pneumoniae. V roce 2005 bylo v ČR podle EARSS Annual Report rezistentních k cefalosporinům 3. generace (cefotaximu nebo coftazidimu) zhruba 3 % izolátů E. coli a 32 % izolátů K. pneumoniae z krve; z toho tvořili producenti ESBL 2 %, respektive 20 % izolátů [6].
C. Detekce ESBL
- Průkaz širokospektrých b-laktamáz využívá inhibici hydrolýzy antibiotika klavulanovou kyselinou.
C.1. Vyhledávání kmenů produkujících ESBL [7]
- Pro základní skríning producentů ESBL lze použít metodu vyhledávání podle průměru inhibičních zón (IZ) okolo disků, nebo podle hodnot minimálních inhibičních koncentrací (MIC) indikátorových b-laktamových antibiotik. Kmen podezřelý z produkce ESBL je takový, který má alespoň jednu hodnotu IZ nižší (nebo MIC vyšší), než je hodnota hraniční. Disková citlivost a stanovení MIC se provádí standardními postupy [8]. Hraniční hodnoty pro diskovou citlivost jsou 17 mm pro cefpodoxim, 22 mm pro ceftazidim a 27 mm pro aztreonam a cefotaxim; hraniční hodnoty MIC jsou 8 mg/l pro cefpodoxim a 1 mg/l pro ceftazidim, aztreonam a cefotaxim [7].
C.2. Konfirmační metoda CLSI* [7]
- Tato metoda využívá srovnání průměru inhibičních zón, které vytváří testovaný kmen na Mueller-Hinton agaru okolo disků s určitým cefalosporinem a okolo disku obsahujícím kombinaci téhož cefalosporinu s klavulanovou kyselinou. Je-li rozdíl průměru inhibičních zón větší než 5 mm (větší zóna musí být vždy u disku s kombinací), je kmen hodnocen jako producent ESBL.
Metoda platí jen pro druhy Klebsiella spp., Escherichia coli a Proteus mirabilis. Vzhledem k mechanistickému pojetí je zatížena statistickou chybou.
* Clinical Laboratory Standard Institute, USA
C.3. Metoda DDST** [5, 9, 10]
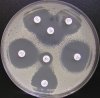
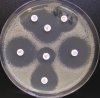
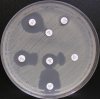
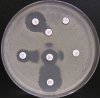
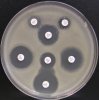
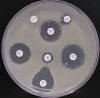
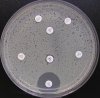
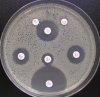
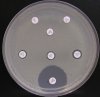
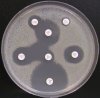
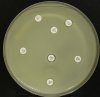
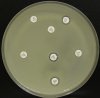
- Metoda je založena na principu detekce deformace inhibičních zón, které vytváří testovaný kmen na Mueller-Hinton agaru mezi disky s cefalosporiny a aztreonamem, a diskem s amoxicilinem/klavulanovou kyselinou. Vzdálenost disků je v rozmezí 20 - 30 mm od středů, podle testovaného druhu a zkušenosti laboratoře. Doporučené kombinace a rozložení disků ukazuje obrázek 1.
** Double Disk Synergy Test
C4. Rychlá detekce ESBL.
- Výsledky produkce ESBL jsou k dispozici nejdříve za 2 dny po indikaci vyšetření citlivosti, čili za jeden den po odečtení MIC nebo průměrů inhibičních zón. V rutinní praxi mikrobiologické laboratoře lze však zhruba 90% producentů ESBL odhalit za jeden den (zhruba za 18 hod), současně s odečtením výsledků vyšetření citlivosti ostatních antibiotik. Postupuje se jako u metody DDST s tím rozdílem, že inokulum vyšetřovaného kmene se naočkuje roztěrem na ½ Mueller-Hinton agaru, na kterou se umístí tři disky, obvykle ceftazidim, kombinace amoxicilinu s klavulanovou kyselinou a cefotaxim. Na druhé polovině plotny se stejným způsobem vyšetří další kmen. Je-li následující den výsledek negativní, postupuje se podle odstavce C1. Podrobný postup vyšetření je uveden v grafu 1.
D. Detekce AmpC [3]
- Pro detekci inducibilních enzymů typu AmpC lze použít totéž uspořádání jako pro metodu DDST při detekci ESBL. Klavulanová kyselina, obsažená v disku s amoxicilinem, je stejně dobrý induktor b-laktamázy AmpC, jako je cefoxitin nebo imipenem. Vzdálenost disků je v rozmezí 20-30 mm od středů.
E. Hodnocení výsledků
- Metoda DDST [5, 9, 10]
Producent ESBL vytváří zvětšenou inhibiční zónu, obvykle ve tvaru „zátky od šampaňského", kolem disku alespoň jednoho z antibiotik (aztreonamu, cefotaximu, ceftazidimu, cefepimu) na straně sousedící s diskem kombinace amoxicilin/klavulanová kyselina.
Producent inducibilní AmpC [3] vytváří deformovanou inhibiční zónu ve tvaru písmene D u aztreonamu nebo některého z cefalosporinů na straně sousedící s diskem kombinace amoxicilin/klavulanová kyselina (resp. cefoxitinu, nebo imipenemu).
Produkce ESBL může být skryta, pokud kmen současně produkuje AmpC. Pro průkaz ESBL je nutno produkci AmpC inhibovat (viz odstavec F).
- Metoda CLSI [7]
Producent ESBL vytváří inhibiční zóny mezi diskem s cefalosporinem a diskem obsahujícím kombinaci téhož cefalosporinu s klavulanovou kyselinou, pokud je rozdíl průměrů ³ 5 mm ve prospěch disku s kombinací.
Producent inducibilní AmpC obvykle vytváří inhibiční zóny kolem disku kombinace cefalosporinu s klavulanovou kyselinou o menším průměru, než kolem disku se samotným cefalosporinem.
Produkce ESBL může být skryta, pokud kmen současně produkuje AmpC, a to i v případě, že se použije cefalosporin 4. generace a tentýž cefalosporin v kombinaci s klavulanovou kyselinou. Pro průkaz ESBL je nutno produkci AmpC inhibovat (viz odstavec F).
F. Detekce ESBL v přítomnosti AmpC
- Enzymy typu AmpC inhibuje kyselina boritá, kloxacilin, a další látky. Tyto inhibitory lze využít k selektivní inhibici enzymu AmpC [3].
- ESBL v přítomnosti AmpC lze detekovat na Mueller-Hinton agaru se 128 mg/l oxacilinu (viz tabulka 2). Další postup metody a hodnocení je shodné jako u průkazu ESBL (viz odstavec C a E a obrázek 1).
- Pokud je průměr inhibičních zón okolo disků na plotně s Mueller-Hinton agarem s oxacilinem větší, než na Mueller-Hinton agaru bez oxacilinu, jedná se o produkci enzymu typu AmpC.
G. Interpretace výsledků
- Charakteristické fenotypy citlivosti a rezistence lze rozeznat podle tvaru inhibičních zón kolem disků s b-laktamovými antibiotiky na půdě Mueller-Hinton agaru a na Mueller-Hinton agaru se 128 mg/l oxacilinu. Tabulka 3 uvádí citlivý fenotyp (3a) a pět fenotypů rezistence (3b-3f) k b-laktamovým antibiotikům u enterobakterií.
- Při interpretaci výsledků je také potřeba brát v úvahu deformace zón, které nejsou způsobeny producenty ESBL. Jedná se například o rozšíření inhibiční zóny okolo disku cefepimu směrem k disku s amoxicilinem s klavulanovou kyselinou, které je obvykle způsobeno enzymem SHV-1 u druhu Klebsiella pneumonie. Tato zóna má charakteristický tvar, připomínající vajíčko („egg-like") (Tabulka 3c).
- Druh Klebsiella oxytoca inherentně produkuje enzym K1, který je inhibován klavulanovou kyselinou. Hyperprodukce tohoto enzymu, která se při použití metody DDST jeví jako vajíčku podobné rozšíření inhibiční zóny u disků s cefalosporiny a/nebo s aztreonamem směrem k disku kombinace amoxicilin/klavulanová kyselina, může být chybně odečtena jako produkce ESBL [9].
Literatura
1. Queenan AM, Foleno B, Gownley C, Wira E, Bush K. Effects of inoculum and b-lactamase activity in AmpC- and extended-spectrum b-lactamase (ESBL)-producing Escherichia coli and Klebsiella pneumoniae clinical isolates tested by using NCCLS ESBL methodology. J Clin Microbiol 2004; 42: 269-275.
2. Coudron PE. 2005. Inhibitor-based methods for detection of plasmid-mediated AmpC b-lactamases in Klebsiella spp., Escherichia coli, and Proteus mirabilis. J Clin Microbiol 2005; 43: 4163-4167.
3. Dunne MW, Hardin DJ. Use of several inducer and substrate antibiotic combinations in a disk approximation assay format to screen for AmpC induction in patient isolates of Pseudomonas aeruginosa, Enterobacter spp., Citrobacter spp., and Serratia spp. J Clin Microbiol 2005; 43: 5945-5949.
4. Livermore DM. b-lactamases in laboratory and clinical resistance. Clin Microbiol Rev 1995; 8: 557-584.
5. Bradford P. Extended-spectrum b-lactamases in the 21st century: Characterization, epidemiology, and detection of this important resistance threat. Clin Microbiol Rev 2001; 14: 933 - 951.
6. Urbášková P, Jakubů V, Žemličková H, Macková B, a CZ-EARSS. Rezistence k antibiotikům u sedmi druhů invazivních bakterií, sledovaných v rámci EARSS v České republice v letech 2000 - 2006. Prakt lék 2007; v tisku.
7. Clinical Laboratory Standards Institute. Performance standards for antimicrobial susceptibility testing: Sixteenth informational supplement. CLSI Document M100-S-16, PA, USA; 2006.
8. Urbášková P. 1998. Rezistence bakterií k antibiotikům. Vybrané metody. Trios.
9. Livermore D, Winstanley TG, Shannon KP. Interpretative reading: recognizing the unusual and inferring resistance mechanisms from resistance phenotypes. J Antimicrob Chemother 2001; 48: 87-102.
10. Paterson DL, Bonomo RA. Extended-spectrum b-lactamases: A clinical update. Clin Microbiol Rev 2005; 18: 657-686.
Jaroslav Hrabák, Tamara Bergerová
Ústav mikrobiologie, LF UK a FN Plzeň
Václav Vaniš
Oddělení klinické mikrobiologie, Nemocnice Na Homolce, Praha
Pavla Urbášková
Národní referenční laboratoř pro antibiotika, CEM-SZÚ Praha
TABULKY A OBRÁZKY:
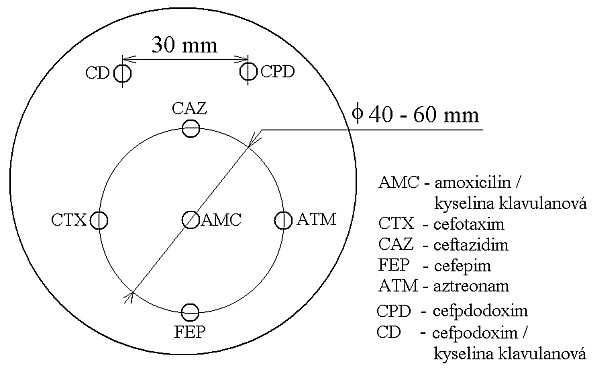
Obrázek 1. Doporučené uspořádání disků při metodě DDST, kombinované s metodou CLSI
Vysvětlivky a zkratky:
Metoda DDST : viz odstavec C3 v textu; metoda CLSI: viz odstavec C2 v textu; Kódové označení disků (obsah disku): AMC: kombinace amoxicilin/klavulanová kyselina. (20/10µg); AZT: aztreonam (30µg); CAZ: ceftazidim (30µg); CPD: cefpodoxim (10µg); CD: kombinace cefpodoxim/klavulanová kyselina (10/1µg); CTX: cefotaxim (30µg); FEP: cefepim (30µg).
Graf 1. Algoritmus průkazu ESBL a AmpC (kliknutím na obrázek jej zvětšíte)
Vysvětlivky a zkratky:
MHA: Mueller-Hinton agar; MHA+OXA: Mueller-Hinton agar s 128 mg/l oxacilinu
Kódové označení disků (obsah disku): AMC: kombinace amoxicilin/klavulanová kyselina. (20/10µg); AZT: aztreonam (30µg); CAZ: ceftazidim (30µg); CPD: cefpodoxim (10µg); CD: kombinace cefpodoxim/klavulanová kyselina (10/1µg); CTX: cefotaxim (30g); FEP: cefepim (30µg).
Tabulka 1. Podmínky pro průkaz ESBL u enterobakterií
| Půda | Mueller- Hinton agar |
| Objem inokula | 2 – 5 ml ve fyziologickém roztoku |
| Příprava inokula | Přímá metoda roztěrem kolonií (z kultury na krevním agaru staré nejvýše 24 hod.) |
| Koncentrace inokula | 0,5 dle McFarlandova zákalu (případně dále ředit 1:10 nebo 1:100); kolonie se mají okraji dotýkat, avšak nesplývat |
| Disky | Amoxicilin/kyselina klavulanová (20/10 µg), cefotaxim (30 µg), ceftazidim (30 µg), cefepim (30 µg), aztreonam (30 µg), cefpodoxim (30 µg), cefpodoxim/k. klavulanová (30/10 µg) |
| Uspořádání disků | Viz obrázek 1 |
| Inkubace | 35 °C ± 2 °C v normální atmosféře |
| Pozitivní kontrola | Escherichia coli CNCTC 7374 (producent ESBL) |
Tabulka 2. Podmínky pro průkaz ESBL v přítomnosti AmpC u enterobakterií.
| Půda | Mueller-Hinton agar + 128 mg/l oxacilinu |
| Objem inokula | 2 – 5 ml ve fyziologickém roztoku |
| Příprava inokula | Přímá metoda roztěrem kolonií (z kultury na krevním agaru staré nejvýše 24 hod.) |
| Koncentrace inokula | 0,5 dle McFarlandova zákalu (případně dále ředit 1:10 nebo 1:100); kolonie se mají okraji dotýkat, avšak nesplývat |
| Disky | Amoxicilin/kyselina klavulanová (20/10 µg), cefotaxim (30 µg), ceftazidim (30 µg), cefepim (30 µg), aztreonam (30 µg), cefpodoxim (30 µg), cefpodoxim/k. klavulanová (30/10 µg) |
| Uspořádání disků | Viz obrázek 1 |
| Inkubace | 35 °C ± 2 °C v normální atmosféře |
| Pozitivní kontrola | Escherichia coli CNCTC 7376 (producent ESBL+AmpC) |
Tabulka 3. Fenotypy rezistence k ß-laktamovým antibiotikům u enterobakterií podle charakteru inhibičních zón
Vysvětlivky: MHA - Mueller-Hinton agar; MHA+OXA: MHA se 128 mg/l oxacilinu; IZ - průměr inhibiční zóny kolem disku



 cz
cz