Předběžná identifikace anaerobních bakterií
12. prosinec 2007 | Magda Balejová
Předběžná identifikace anaerobních bakterií je založená na makroskopické a mikroskopické morfologii a výsledku jednoduchých testů. Je zaměřena na nejčastěji izolované anaeroby z klinických vzorků. Zvyšuje rychlost a snižuje cenu vyšetření. V mnoha případech je konečnou a dostačující identifikací. Ačkoliv je považována za validní, nemusí být.
Úvod
Při zpracování vzorků na anaerobní kultivaci často stojíme před otázkou. „Jak detailní identifikaci izolovaných kultur provést?"
Anaerobní kultivace je sama o sobě časově i finančně poměrně náročná, izolace identifikovaných kultur často také. Je detailní zařazení izolované bakterie do druhu skutečnou potřebou klinika? Jiná je samozřejmě situace při izolaci jednoho druhu anaerobní bakterie z hemokultury nebo izolaci anaerobních bakterií například z abscesu mozku. Tady může identifikace napomoci i při hledání zdroje infekce. A jiná je situace při izolaci několika druhů anaerobních bakterií například z hnisu z břišní dutiny. Úroveň identifikace by měla odpovídat klinické závažnosti odebraného vzorku, počtu a typu izolovaných kmenů, pacientově stavu a potřebě klinika [1].
K identifikaci lze užít buď komerčních biochemických souprav, kdy úspěšnost identifikace je dána databází systému nebo jednoduchých testů, které umožní „předběžnou identifikaci". U závažných izolátů je možné kombinovat oba způsoby, což může pomoci při nepřesvědčivém výsledku identifikace pomocí komerční soupravy. V současné době nabývá na významu, v odůvodněných případech, i identifikace izolovaných kultur pomocí PCR.
Materiál a metody
1/ Testy používané k pravděpodobné identifikaci anaerobních bakterií [1, 2, 3]:
- Makroskopická morfologie kolonií
- Mikroskopická morfologie a barvitelnost dle Grama
- ATB diagnostické disky - KANAMYCIN 1000 µg
- VANKOMYCIN 5 µg
- COLISTIN 10 µg
- SPS (sodium polyanethol sulfonate) 1000 µg
- Růst v přítomnosti 20 % žluči, štěpení eskulinu (BBE - žluč - eskulinový agar)
- Nitráty
- Kataláza 15 %
- Indol
- Lecitináza a lipáza (EYA - egg yolk agar - žloutkový agar)
- Ureáza
2/ Kultivační půdy
- Neselektivní anaerobní krevní agar
- Selektivní anaerobní krevní agar (s kys. nalidixovou a kolistinem) pro izolaci gram- pozitivních anaerobních bakterií
- Selektivní anaerobní krevní agar (s kys. nalidixovou a vankomycinem) pro izolaci gram- negativních anaerobních bakterií
- Anaerobní tekutá pomnožovací půda, převrstvená parafínovým olejem.
3/ Pracovní postup užívaný při anaerobní kultivaci
Biologický materiál (hnis, punktát, výtěr v transportním médiu pro anaerobní kultivaci, atd.) je naočkován na kultivační půdy pro aerobní a mikroaerofilní kultivaci a dále na kultivační půdy pro anaerobní kultivaci, tj. neselektivní anaerobní krevní agar, selektivní anaerobní krevní agar (s kys. nalidixovou a vankomycinem), anaerobní bujón a zhotoven mikroskopický preparát. Anaerobní půdy jsou ihned vloženy do anaerobního boxu se směsí plynů : 80 % N2, 10 % CO2, 10 % H2. První hodnocení anaerobní kultivace je prováděno po dvou dnech. Je zhotoven mikroskopický preparát a z jednotlivých makroskopicky morfologicky odlišných kultur jsou zhotoveny subkultury paralelně na krevní agar, kultivovaný mikroaerofilně a neselektivní anaerobní krevní agar kultivovaný anaerobně. Při potřebě selektivní izolace grampozitivních bakterií je provedeno rozočkování na selektivní anaerobní, event. aerobní krevní agar pro izolaci grampozitivních bakterií.
Kultivace původních ploten pokračuje. Subkultury jsou hodnoceny za 24 a 48 hodin, při negativitě je kultivace prodloužena. Subkultury vyrostlé pouze anaerobně jsou porovnávány s primokulturami na původních půdách (makroskopická morfologie, tvorba pigmentu). Z jednotlivých subkultur jsou zhotoveny mikroskopické preparáty. Podle výsledku mikroskopie jsou, u z klinického hlediska významných kultur, naočkovány testy podle schémat (viz příloha) pro jednotlivé morfotypy. Výsledky testů jsou hodnoceny za 24, 48 hodin, event., při pomalém růstu kultury, i déle. U rychle rostoucích anaerobních bakterií lze tedy identifikace dosáhnout již třetí den po naočkování biologického materiálu.
Identifikace
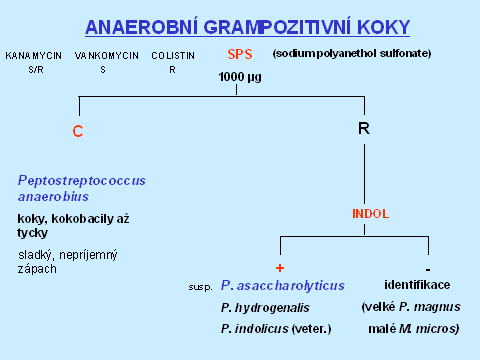
Rezistence k diagnostickým diskům (kanamycin 1000 µg, vankomycin 5 µg, kolistin 10 µg) - viz tabulka 1 - ukáže skutečnou barvitelnost dle Grama. Některé grampozitivní bakterie se totiž barví gramnegativně - např. Mobiluncus, nebo některá klostrida.
Tabulka 1.

Grampozitivní koky citlivé k SPS 1000 µg (sodium polyanethol sulfonate) jsou Peptostreptococcus anaerobius. Grampozitivní koky rezistentní k SPS, indol pozitivní jsou pravděpodobně P. asaccharolyticus. Kromě tohoto peptostreptokoka jsou indol pozitivní jen P. hydrogenalis (vzácně izolovaný z gynekologických materiálů) a P. indolicus (z veterinárních vzorků) - tabulka 2.
Tabulka 2.
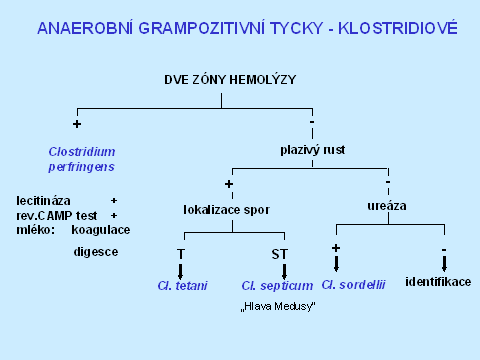
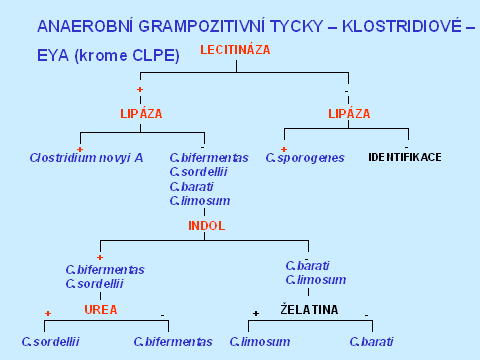
V diagnostice klostridií je užití diagnostických disků také velmi důležité, protože ne všechna klostridia jsou „velká a grampozitivní". Některá se barví gramnegativně - Clostridium ramosum a mohou mít i fusiformní morfologii - C. clostridiiforme, C. sphenoides. Nejčastěji izolovaným klostridiem je C. perfringens s typickou morfologií - mikroskopicky velké, silné, grampozitivní, rovné tyčky, makroskopicky - velké kolonie, obklopené dvojitou zónou hemolýzy, s pozitivní lecitinázou a reverzním CAMP testem. V diagnostice ostatních klostridií může pomoci lecitináza, lipáza, ureáza, plazivý růst, lokalizace spor a indol - viz tabulky 3 a 4. Většinou je ale zapotřebí identifikaci ověřit komerčním biochemickým setem, zvláště u klinicky významných izolátů.
Takulka 3.
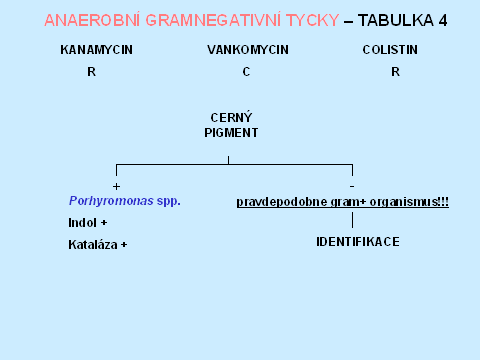
Tabulka 4.
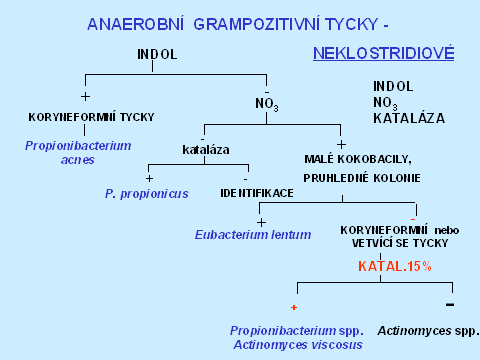
V rozlišování anaerobních grampozitivních nesporulujících tyček jsou důležitými testy indol, kataláza a nitráty. Nejčastěji izolujeme Propionibacterium acnes. Má typickou makroskopickou i mikroskopickou morfologii, je kataláza pozitivní a většina kmenů je indol pozitivní (tabulka 5).
Tabulka 5.
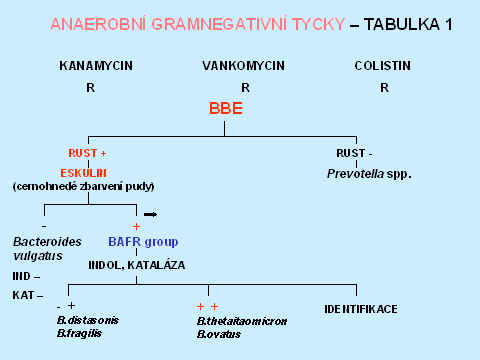
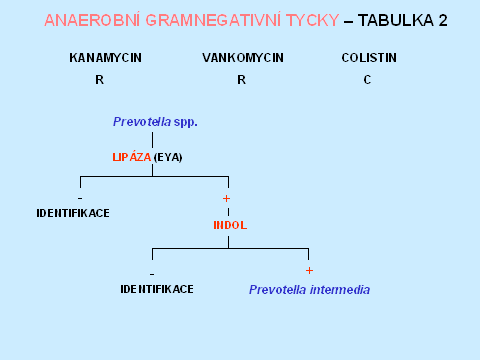
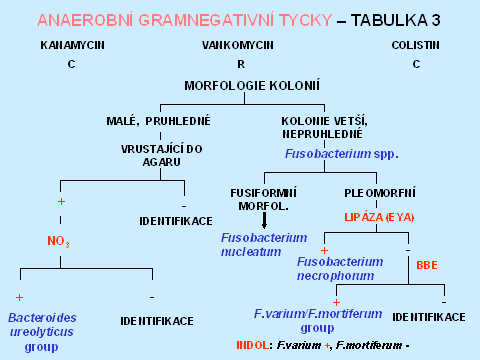
Anaerobní gramnegativní tyčky tvoří asi 43 % všech anaerobních izolátů [1]. Rezistence k diagnostickým diskům - kanamycin, vankomycin, colistin, rezistence k 20% žluči, štěpení eskulinu, lipáza, indol, nitráty a kataláza umožní orientační zařazení do jednotlivých bakteriálních rodů, v některých případech i druhové dourčení. Rezistence k 20 % žluči je typická pro příslušníky Bacteroides fragilis group, stejně jako štěpení eskulinu, s výjimkou B. vulgatus, který je eskulin negativní. Naopak Fusobacterium varium/mortiferum rovněž roste na půdě s 20 % žluči. Pozitivní lipáza a indol umožní identifikaci Prevotella intermedia. V diagnostice je také důležitá makroskopická i mikroskopická morfologie, která spolu s typem rezistence k diagnostickým diskům, je např. dostačující k identifikaci Fusobacterium nucleatum, které má jediné z fusobakterií fusiformní morfologii. Při identifikaci Porphyromonas spp., která má vztah k diagnostickým diskům, odpovídající grampozitivním organismům, je důležitým znakem tvorba černého pigmentu (tabulky 6 - 10).
Tabulka 6.
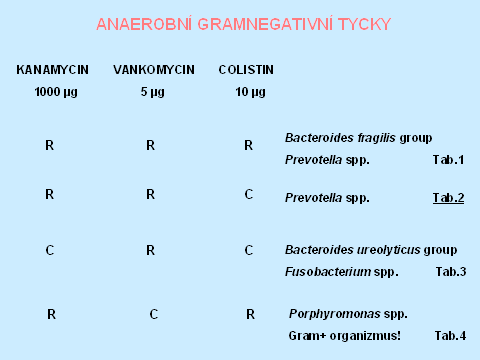
Tabulka 7.
Tabulka 8.
Tabulka 9.
Tabulka 10.
V identifikaci anaerobních gramnegativních koků jsou jediným důležitým testem nitráty, protože pouze Veillonella spp. má tento test pozitivní. Uvádí se, že ostatní gramnegativní koky většinou nemají klinický význam [1] - tabulka 11.
Tabulka 11.
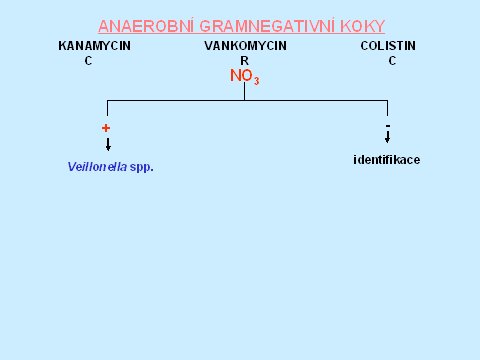
Výraz „identifikace" v identifikačních schématech znamená, že kmen nelze pomocí testů „Předběžné identifikace" dourčit a v případě potřeby je nutné užít komerční identifikační soupravu event. PCR.
Diskuse
Předběžná identifikace bakterií, založená na makroskopické a mikroskopické morfologii a výsledku jednoduchých testů, je běžně užívána i v diagnostice aerobních a fakultativně anaerobních bakterií. Příkladem může být identifikace Streptococcus pyogenes a enterokoků pomocí PYR testu, Streptococcus agalactiae pomocí CAMP testu, rozlišení plazivých kmenů Proteus spp. pomocí indolu na Proteus mirabilis a Proteus vulgaris nebo identifikace Pseudomonas aeruginosa pomocí typického vzhledu, vůně a pozitivní oxidázy a acetamidu.
Druhová identifikace anaerobních bakterií může být při použití komerčních biochemických souprav finančně poměrně náročná. Použití několika jednoduchých testů ve spojení s morfologií izolátu, může v řadě případů dát dostačující rodovou nebo i druhovou identifikaci. Z klinického hlediska je často už pouhá informace o přítomnosti anaerobních bakterií velmi důležitá a vzhledem k vysoké pravděpodobnosti účinku některých antibiotik (chloramfenikol, beta-laktamová antibiotika s inhibitorem beta-laktamázy, imipenem a metronidazol [1]) svým způsobem i dostačující. Stanovení beta-laktamázy může navíc odlišit kmeny rezistentní k penicilinu.
Chloramfenikol je však antibiotikum se závažnými nežádoucími účinky vhodné jen k terapii život ohrožujících stavů, jako jsou nitrolební abscesy. Beta-laktamová antibiotika s inhibitorem beta-laktamázy a imipenem nejsou účinné u většiny kmenů Bilophila wadsworthia. Metronidazol není účinný na grampozitivní nesporulující tyčky a některé kmeny grampozitivních koků. Negativní výsledek beta-laktamázy nemusí znamenat vždy citlivost kmene k penicilinu. Některé kmeny Bacteroides fragilis group nebo např. Bacteroides gracilis, mohou totiž mít jiný mechanismus rezistence.
Kmeny Bacteroides fragilis group, by však měly být považovány za penicilin rezistentní i při negativitě beta-laktamázy. Proto je dourčení kmene alespoň do úrovně Bacteroides fragilis group, které jsou nejčastějšími anaerobními klinickými izoláty, velmi důležité. Dourčení agens může i napomoci při pátrání po zdroji infekce. Např. při izolaci orálních anaerobů z hemokultury nebo abscesu mozku je třeba pátrat po zdroji v ústní dutině. Dourčeny by měly být i kmeny ze vzorků s méně než třemi izoláty.
Závěr
Pravděpodobná identifikace anaerobních bakterií, založená na jednoduchých testech, je v mnoha případech konečnou, rychlou, ekonomicky nenáročnou a dostačující identifikací. Je považována za validní, ale nemusí být. V případech klinicky významných izolátů je někdy zapotřebí ji doplnit komerčním biochemickým setem event. identifikací pomocí PCR. Dourčeny by měly být kmeny, izolované z klinicky závažných materiálů, kmeny od pacientů s těžkým průběhem onemocnění a jsou-li izolovány ze vzorku méně než 3 různé kultury.
Literatura
1. Engelkirk PG, Duben-Engelkirk J, Dowell VR. Jr. Principles and Practise of Clinical Anaerobic Bacteriology, 1992
2. Summanen P, Baron EJ, Citron DM, Strong C,Wexler HM, Finegold SM. Wadsworth Anaerobic Bacteriology Manual, Reprint of selected pages
3. Isenberg HD. Clinical Microbiology Procedures Handbook, 1992
4. Murray PR, Baron EJ, Pfaller MA, Tenover FC, Yolken RH. Manual of Clinical Microbiology, 7th edition, 1999
Poděkování
Děkuji Janu Němcovi za pomoc při grafickém zpracování identifikačních schémat.
Magda Balejová,
Laboratoř bakteriologie,
Nemocnice České Budějovice a.s



 cz
cz

